高效的复习,要学会梳理自身学习情况,以课本为基础,结合自己做的笔记、试卷、掌握的薄弱环节、存在的问题等,今天小编在这给大家整理了高一化学知识点总结,接下来随着小编一起来看看吧!
高一化学知识点总结
第一章 从实验学化学
第一节 化学实验基本方法
一、熟悉化学实验基本操作
危险化学品标志,如酒精、汽油——易燃液体;
浓H2SO4、NaOH(酸碱)——腐蚀品
二、混合物的分离和提纯:
1、分离的方法:
①过滤:固体(不溶)和液体的分离。
②蒸发:固体(可溶)和液体分离。
③蒸馏:沸点不同的液体混合物的分离。
④分液:互不相溶的液体混合物。
⑤萃取:利用混合物中一种溶质在互不相溶的溶剂里溶解性的不同,用一种溶剂把溶质从它与另一种溶剂所组成的溶液中提取出来。
2、粗盐的提纯:
(1)粗盐的成分:主要是NaCl,还含有MgCl2、CaCl2、Na2SO4、泥沙等杂质
(2)步骤:
①将粗盐溶解后过滤;
②在过滤后得到粗盐溶液中加过量试剂BaCl2(除SO42-)、Na2CO3(除Ca2+、过量的Ba2+)、NaOH(除Mg2+)溶液后过滤;
③得到滤液加盐酸(除过量的CO32-、OH-)调pH=7得到NaCl溶液;
④蒸发、结晶得到精盐。
加试剂顺序关键:
(1)Na2CO3在BaCl2之后;
(2)盐酸放最后。
3、蒸馏装置注意事项:
①加热烧瓶要垫上石棉网;
②温度计的水银球应位于蒸馏烧瓶的支管口处;
③加碎瓷片的目的是防止暴沸;
④冷凝水由下口进,上口出。
4、从碘水中提取碘的实验时,选用萃取剂应符合原则:
①被萃取的物质在萃取剂溶解度比在原溶剂中的大得多;
②萃取剂与原溶液溶剂互不相溶;
③萃取剂不能与被萃取的物质反应。
三、离子的检验:
①SO42-:先加稀盐酸,再加BaCl2溶液有白色沉淀,原溶液中一定含有SO42-。Ba2++SO42-=BaSO4↓
②Cl-(用AgNO3溶液、稀硝酸检验)加AgNO3溶液有白色沉淀生成,再加稀硝酸沉淀不溶解,原溶液中一定含有Cl-;或先加稀硝酸酸化,再加AgNO3溶液,如有白色沉淀生成,则原溶液中一定含有Cl-。Ag++Cl-=AgCl↓。
③CO32-:(用BaCl2溶液、稀盐酸检验)先加BaCl2溶液生成白色沉淀,再加稀盐酸,沉淀溶解,并生成无色无味、能使澄清石灰水变浑浊的气体,则原溶液中一定含有CO32-。
第二节 化学计量在实验中的应用
1、物质的量(n)是国际单位制中7个基本物理量之一。
2、五个新的化学符号:
概念、符号 | 定义 | 注 意 事 项 |
物质的量: n | 衡量一定数目粒子集体的物理量 | ①摩尔(mol)是物质的量的单位,只能用来衡量微观粒子:原子、分子、离子、原子团、电子、质子、中子等。 ②用物质的量表示微粒时,要指明粒子的种类。 |
阿伏加德罗常数: NA | 1mol任何物质所含粒子数。 | NA有单位:mol-1或 /mol,读作每摩尔, NA≈6.02×1023mol-1。 |
摩尔质量: M | 单位物质的量物质所具有的质量 | ①一种物质的摩尔质量以g/mol为单位时,在数值上与其相对原子或相对分子质量相等。 ②一种物质的摩尔质量不随其物质的量变化而变 |
气体摩尔体积: Vm | 单位物质的量气体所具有的体积 | ①影响气体摩尔体积因素有温度和压强。 ②在标准状况下(0℃,101KPa)1mol任何气体所占体积约为22.4L即在标准状况下,Vm≈22.4L/mol |
物质的量浓度: C | 单位体积溶液所含某溶质B物质的量。 | ①公式中的V必须是溶液的体积;将1L水溶解溶质或者气体,溶液体积肯定不是1L。 ②某溶质的物质的量浓度不随所取溶液体积多少而变 |
3、各个量之间的关系:
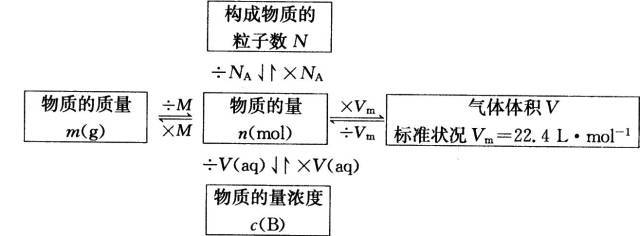
4、溶液稀释公式:(根据溶液稀释前后,溶液中溶质的物质的量不变)
C浓溶液V浓溶液=C稀溶液V稀溶液 (注意单位统一性,一定要将mL化为L来计算)。
5、溶液中溶质浓度可以用两种方法表示:
①质量分数W
②物质的量浓度C
质量分数W与物质的量浓度C的关系:C=1000ρW/M(其中ρ单位为g/cm3)
已知某溶液溶质质量分数为W,溶液密度为ρ(g/cm3),溶液体积为V,溶质摩尔质量为M,求溶质的物质的量浓度C。
【 推断:根据C=n(溶质)/V(溶液) ,而n(溶质)=m(溶质)/M(溶质)= ρ V(溶液) W/M,考虑密度ρ的单位g/cm3化为g/L,所以有C=1000ρW/M 】。(公式记不清,可设体积1L计算)。
6、一定物质的量浓度溶液的配制
(1)配制使用的仪器:托盘天平(固体溶质)、量筒(液体溶质)、容量瓶(强调:在具体实验时,应写规格,否则错!)、烧杯、玻璃棒、胶头滴管。
(2)配制的步骤:
①计算溶质的量(若为固体溶质计算所需质量,若为溶液计算所需溶液的体积)
②称取(或量取)
③溶解(静置冷却)
④转移
⑤洗涤
⑥定容
⑦摇匀。
(如果仪器中有试剂瓶,就要加一个步骤:装瓶)。
例如:配制400mL0.1mol/L的Na2CO3溶液:
(1)计算:需无水Na2CO3 5.3 g。
(2)称量:用托盘天平称量无水Na2CO3 5.3 g。
(3)溶解:所需仪器烧杯、玻璃棒。
(4)转移:将烧杯中的溶液沿玻璃棒小心地引流到500mL容量瓶中。
(5)定容:当往容量瓶里加蒸馏水时,距刻度线1-2cm处停止,为避免加水的体积过多,改用胶头滴管加蒸馏水到溶液的凹液面正好与刻度线相切,这个操作叫做定容。
注意事项:
①不能配制任意体积的一定物质的量浓度的溶液,这是因为容量瓶的容积是固定的,没有任意体积规格的容量瓶。
②溶液注入容量瓶前需恢复到室温,这是因为容量瓶受热易炸裂,同时溶液温度过高会使容量瓶膨胀影响溶液配制的精确度。
③用胶头滴管定容后再振荡,出现液面低于刻度线时不要再加水,这是因为振荡时有少量溶液粘在瓶颈上还没完全回流,故液面暂时低于刻度线,若此时又加水会使所配制溶液的浓度偏低。
④如果加水定容时超出了刻度线,不能将超出部分再吸走,须应重新配制。
⑤如果摇匀时不小心洒出几滴,不能再加水至刻度,必须重新配制,这是因为所洒出的几滴溶液中含有溶质,会使所配制溶液的浓度偏低。
⑥溶质溶解后转移至容量瓶时,必须用少量蒸馏水将烧杯及玻璃棒洗涤2—3次,并将洗涤液一并倒入容量瓶,这是因为烧杯及玻璃棒会粘有少量溶质,只有这样才能尽可能地把溶质全部转移到容量瓶中。
高中化学学习方法总结
1、 初中化学与高中化学的不同点在哪儿?
不同点一:需要背诵的东西不同。初中化学注重的是化学基本工具的背诵,例如:元素符号、化合价、化学式、基本简单化学方程式等;但高中化学主要注重物质间的相互转化、相互联系,需要记忆的化学方程式更多、更繁,注意寻找规律,形成有效的方法,达到事半功倍的效果。
不同点二:知识点深度不同。初中化学更多是兴趣教学,所以实验等很多,更多让学生形成化学是一个怎样的学科的思维,需要掌握的知识点较简单;而高中化学更多要去挖一些现象背后的本质,如:为什么物质之间会发生这样的反应?它们反应的原理是什么?通过这个反应推导其它反应的原理又会是什么?……诸如此类需要更加深入去掌握化学知识。
不同点三:学生的兴趣点不同。初中化学学生更多会觉得好玩,因为实验多,知识点简单,比较新奇,兴趣更高;高中化学更需要真正喜欢这门学科,需要有一种钻研精神,找到这门学科真正的魅力所在。
2、 怎么才能学好高中化学?深大家教高中化学
认真听课,做好笔记。
好的笔记是教科书知识的浓缩、补充和深化,是思维过程的展现与提炼。
由于化学学科知识点既多又零碎、分散,所以,课堂上除了认真听课,积极思考外,还要在理解的基础上,用自己的语言记下老师讲的重点、难点知识,以及思路和疑难点,便于今后复习。
及时复习,巩固新知。
复习并不仅仅是对知识的简单回顾,而是在自己的大脑中考虑新旧知识的相互联系,并进行重整,形成新的知识体系。所以,课后要及时对听课内容进行复习,做好知识的整理和归纳,这样才能使知识融会贯通,避免出现越学越乱的现象。比如学习了SO2的漂白性就跟氯水的漂白性进行比较,找出两者的不同之处。
学会巧记,融会贯通。
由于要记的化学知识点比较多,如果靠死记硬背是难以记牢的,所以应学会巧记。化学上常用的记忆方法有:比较法(常用于容易混淆、相互干扰的知识。如同位素、同素异形体、同系物、同分异构体四个相似的概念,可以通过比较,使理解加深,记忆牢固。)、归纳法、歌诀记忆法、理解记忆法和实验记忆法。
勤加练习,灵活运用。深大家教高中化学
练习是理解消化巩固课堂知识的重要途径。但练习要有针对性,不能搞题海战术,应以掌握基本方法和解题规律为目标。在解题过程中,要注意一题多解和归纳总结,这样才能达到做一题会一类的效果。如化学计算中常用的技巧法有:守恒法、关系式法、极值法、平均值法、估算法、差量法等。
备好“错题本”。
做题的目的是培养能力、寻找自己的弱点和不足的有效途径。所以,对平时出现的错题,应做好修正并记录下来。记录时应详细分析出错的原因及正确的解题思路,不要简单写上一个答案了事。同时,要经常翻阅复习,这样就可以避免以后出现类似的错误。深大家教高中化学
暑期衔接学习化学时,对学生有什么好的建议?
把初中必须要掌握、背诵的化学工具进一步的强化、加深,达到顺手拈来的程度,为高中化学打下良好的基础,就够了
高一化学知识点总结(实验学化学)
- 工作总结结尾格式精选版10篇
- 办公室工作总结5篇精选
- 教师工作总结5篇精选
- 月考总结10篇精选
- 部队年终工作总结6篇精选
- 银行信贷员工作总结
- 社区工作总结大全
- 消防安全工作总结最新精选10篇
- 个人见习总结15篇精选
- 军训总结5篇精选
- 廉洁自律个人工作总结最新大全
- 教师个人工作总结精选3篇
- 顶岗实习个人总结10篇模板__实习工作总结
- 团委工作总结最新
- 个人总结与自我评价2022
- 廉洁自律个人总结最新
- 2022纪检部工作总结精选5篇
- 后勤工作总结大全
- 前台工作总结大全
- 校运会总结精选5篇
- 保育员工作总结精选10篇
- 驻村工作总结精选集锦
- 2022客服工作总结精选5篇
- 2022师德总结精选5篇
- 后勤工作总结集锦
- technological expertise
- technological imperative
- technological imperative
- technological improvement
- technological infrastructure
- technological innovation
- technological innovation
- technological invention
- technological knowledge
- technological literacy
- 檰
- 檱
- 檲
- 檳
- 檴
- 檵
- 檶
- 檷
- 檸
- 檹
- 宝鸡市扶风县2015年特设教师岗位招募公告
- 2015年衡阳市常宁市特岗教师招聘计划及岗位设置公示
- 毕节市纳雍县2015年农村义务教育阶段学校教师特设岗位计划招聘实施细则
- 毕节市纳雍县2015年硕师计划与特岗计划结合实施推荐人员名单
- 毕节市纳雍县2015年农村义务教育阶段学校教师特设岗位计划学科教师指标分配表
- 毕节市赫章县2015年农村义务教育阶段学校教师特设岗位计划招聘工作实施细则
- 毕节市赫章县2015年农村义务教育阶段学校教师特设岗位计划学科教师指标分配表
- 红河州2015年特岗教师招聘笔试公告
- 2015年四川省特岗教师招聘公告专题汇总
- 2015年特岗教师招聘考试网上报名流程